Casete de proba rápida do antíxeno SARS-CoV-2
Descrición curta:
A proba rápida en casete para o antíxeno SARS-CoV-2 é un inmunoensaio cromatográfico rápido para a detección cualitativa do antíxeno SARS-CoV-2 en frotis orofarínxeos humanos. A identificación baséase nos anticorpos monoclonais específicos para a proteína nucleocápside (N) do SARS-CoV-2. Preténdese axudar no diagnóstico diferencial rápido da infección por COVID-19.
USO PREVISTO
O/ACasete de proba rápida do antíxeno SARS-CoV-2é un inmunoensaio cromatográfico rápido para a detección cualitativa do antíxeno do SARS-CoV-2 en frotis orofarínxeos humanos. A identificación baséase nos anticorpos monoclonais específicos para a proteína nucleocápside (N) do SARS-CoV-2. Preténdese axudar no diagnóstico diferencial rápido deCOVID 19infección.
Especificacións do paquete
25 probas/paquete, 50 probas/paquete, 100 probas/paquete
INTRODUCIÓN
Os novos coronavirus pertencen ao xénero β.COVID 19é unha enfermidade infecciosa respiratoria aguda. As persoas son xeralmente susceptibles. Actualmente, os pacientes infectados polo novo coronavirus son a principal fonte de infección; as persoas infectadas asintomáticas tamén poden ser unha fonte infecciosa. Segundo a investigación epidemiolóxica actual, o período de incubación é de 1 a 14 días, na súa maioría de 3 a 7 días. As principais manifestacións inclúen febre, fatiga e tose seca. Nalgúns casos, obsérvanse conxestión nasal, mucosidade nasal, dor de gorxa, mialxia e diarrea.
REACTIVOS
O casete de proba contén partículas de proteína da nucleocápside anti-SARS-CoV-2 e proteína da nucleocápside anti-SARS-CoV-2 recuberta na membrana.
PRECAUCIÓNS
Lea toda a información deste prospecto antes de realizar a proba.
1. Só para uso profesional en diagnóstico in vitro. Non o use despois da data de caducidade.
2. A proba debe permanecer na bolsa selada ata que estea lista para o seu uso.
3. Todas as mostras deben considerarse potencialmente perigosas e manipularse do mesmo xeito que un axente infeccioso.
4. A proba utilizada debe ser desbotada segundo a normativa local.
5. Evitar o uso de mostras con sangue.
6. Use luvas ao manipular as mostras, evite tocar a membrana do reactivo e o pozo da mostra.
ALMACENAMENTO E ESTABILIDADE
O período de validez é de 18 meses se este produto se almacena nun ambiente de
2-30 ℃. A proba é estable ata a data de caducidade impresa na bolsa selada. A proba debe permanecer na bolsa selada ata o seu uso.NON CONXELAR.Non o use despois da data de caducidade.
RECOLLIDA E PREPARACIÓN DE MOSTRAS
1. Recollida de secrecións da gorxa: Introduza un hisopo estéril na gorxa completamente desde a boca, centrándose na parede da gorxa e na zona avermellada das amígdalas do padal, limpe as amígdalas farínxeas bilaterais e a parede farínxea posterior cun toque moderado.
forza, evite tocar a lingua e retire o hisopo.
2. Procese a mostra inmediatamente coa solución de extracción de mostras incluída no kit despois de recollela. Se non se pode procesar inmediatamente, a mostra debe gardarse nun tubo de plástico seco, esterilizado e estritamente selado. Pode almacenarse a 2-8 ℃ durante 8 horas e pode almacenarse durante moito tempo a -70 ℃.
3. As mostras moi contaminadas por residuos de alimentos orais non se poden usar para as análises deste produto. Non se recomenda o uso de mostras recollidas de hisopos demasiado viscosos ou aglomerados para as análises deste produto. Se os hisopos están contaminados cunha gran cantidade de sangue, non se recomenda a súa análise. Non se recomenda o uso de mostras procesadas cunha solución de extracción de mostras que non se inclúe neste kit para as análises deste produto.
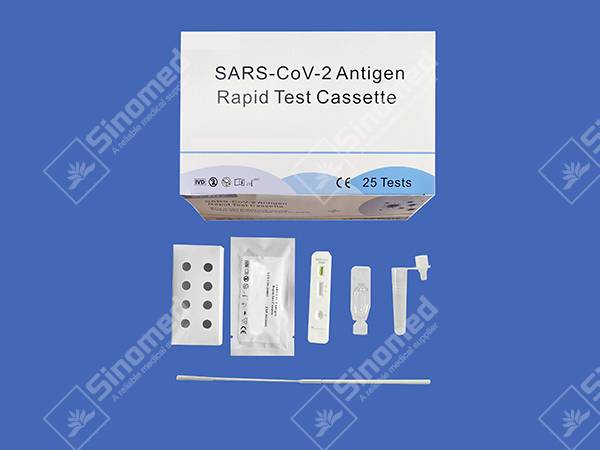
COMPONENTES DO KIT
Materiais proporcionados
| Casetes de proba | Reactivo de extracción | Tubos de extracción | |
| Hisopos estériles | Prospecto do paquete | Estación de traballo |
Materiais necesarios pero non subministrados
| Temporizador | Para uso cronometrado. |
| Paquete |
Especificacións25
probas/paquete50
probas/paquete 100
probas/paquete Reactivo de extracción de mostras 25 probas/paquete 50 probas/paquete 100 probas/paquete Extracción de mostras
tubo ≥25 probas/envase ≥50 probas/envase ≥100 probas/envase Instrucións Consultar as
paqueteConsultar o
paqueteConsultar o
paquete
INSTRUCIÓNS DE USO
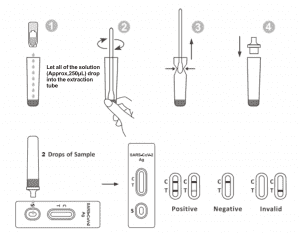
Deixar que a proba, a mostra e o tampón de extracción se equilibren á temperatura ambiente (15-30 ℃) antes da proba.
1. Retire a casete de proba da bolsa de aluminio selada e úsea nos 15 minutos seguintes. Obterás mellores resultados se o ensaio se realiza inmediatamente despois de abrir a bolsa de aluminio.
2. Coloque o tubo de extracción na estación de traballo. Manteña o frasco de reactivo de extracción boca abaixo verticalmente. Aperte o frasco e deixe que toda a solución (aproximadamente 250 μL) caia libremente no tubo de extracción sen tocar o bordo do tubo co tubo de extracción.
3. Coloque a mostra con hisopo no tubo de extracción. Xire o hisopo durante aproximadamente 10 segundos mentres preme a cabeza contra o interior do tubo para liberar o antíxeno no hisopo.
4. Retire o hisopo mentres preme a cabeza do hisopo contra o interior do tubo de extracción mentres o retira para expulsar o máximo líquido posible del. Desbote o hisopo de acordo co seu protocolo de eliminación de residuos biolóxicos perigosos.
5. Coloque a punta do contagotas enriba do tubo de extracción. Coloque o casete de proba sobre unha superficie limpa e nivelada.
6. Engada 2 gotas da solución (aproximadamente 65 μL) ao pozo da mostra e logo inicie o temporizador. Lea o resultado mostrado en 20-30 minutos e os resultados lidos despois de 30 minutos non serán válidos.
INTERPRETACIÓN DOS RESULTADOS
| NEGATIVO RESULTADO: |
Aparece unha liña coloreada na rexión da liña de control (C). Non aparece ningunha liña na rexión da proba (T). Un resultado negativo indica que o antíxeno SARS-CoV-2 non está presente na mostra ou que está presente por debaixo do nivel detectable da proba.
POSITIVORESULTADO:
Aparecen dúas liñas. Unha liña coloreada debería estar na rexión de control (C) e outra liña coloreada aparente debería estar na rexión de proba (T). Un resultado positivo indica que se detectou o SARS-CoV-2 na mostra.
RESULTADO NON VÁLIDO:
A liña de control non aparece. Un volume de mostra insuficiente ou técnicas de procedemento incorrectas son as razóns máis probables do fallo da liña de control. Revise o procedemento e repita a proba cunha nova. Se o problema persiste, deixe de usar o kit de proba inmediatamente e póñase en contacto co seu distribuidor local.
NOTA:
A intensidade da cor na rexión da liña de proba (T) variará dependendo da concentración do antíxeno do SARS-CoV-2 presente na mostra. Polo tanto, calquera ton de cor na rexión da liña de proba (T) debe considerarse positivo.
CONTROL DE CALIDADE
- Inclúese un control procedimental na proba. Unha liña coloreada que aparece na rexión de control (C) considérase un control procedimental interno. Confirma unha absorción axeitada da membrana.
- Os estándares de control non se inclúen con este kit; non obstante, recoméndase analizar os controis positivos e negativos como boa práctica de laboratorio para confirmar o procedemento da proba e verificar o rendemento axeitado da proba.
LIMITACIÓNSDA PROBA
- A proba rápida en casete do antíxeno SARS-CoV-2 é só para uso diagnóstico profesional in vitro. A proba debe utilizarse para a detección do antíxeno SARS-CoV-2 en frotis orofarínxeos. Esta proba cualitativa non permite determinar nin o valor cuantitativo nin a taxa de aumento da concentración de SARS-CoV-2.
- A precisión da proba depende da calidade da mostra do hisopo. Poden producirse falsos negativos debido a un almacenamento inadecuado da recollida de mostras.
- A proba rápida en casete para o antíxeno SARS-CoV-2 só indicará a presenza de SARS-CoV-2 na mostra, tanto de cepas viables como non viables do coronavirus SARS-CoV-2.
- Do mesmo xeito que ocorre con todas as probas diagnósticas, todos os resultados deben interpretarse xunto con outra información clínica da que dispón o médico.
- Un resultado negativo obtido con este kit debe confirmarse mediante PCR. Pode obterse un resultado negativo se a concentración do SARS-CoV-2 presente na mostra non é axeitada ou está por debaixo do nivel detectable da proba.
- O exceso de sangue ou moco na mostra con hisopo pode interferir co rendemento e dar un resultado falso positivo.
- Un resultado positivo para o SARS-CoV-2 non exclúe unha coinfección subxacente con outro patóxeno. Polo tanto, débese considerar a posibilidade dunha infección bacteriana subxacente.
- Os resultados negativos non descartan a infección por SARS-CoV-2, especialmente nas persoas que estiveron en contacto co virus. Deberíase considerar a realización de probas de seguimento cun diagnóstico molecular para descartar a infección nestas persoas.
- Os resultados positivos poden deberse a unha infección presente con cepas de coronavirus que non son o SARS-CoV-2, como os coronavirus HKU1, NL63, OC43 ou 229E.
- Os resultados das probas de antíxenos non deben utilizarse como única base para diagnosticar ou descartar a infección por SARS-CoV-2 nin para informar sobre o estado da infección.
- O reactivo de extracción ten a capacidade de matar o virus, pero non pode inactivalo ao 100 %. O método de inactivación do virus pódese consultar: cal é o método recomendado pola OMS/CDC ou pódese manexar segundo a normativa local.
CARACTERÍSTICAS DE RENDEMENTO
SensibilidadeeEspecificidade
A proba rápida en casete do antíxeno SARS-CoV-2 foi avaliada con mostras obtidas dos pacientes. A PCR utilízase como método de referencia para a proba rápida en casete do antíxeno SARS-CoV-2. As mostras consideráronse positivas se a PCR indicaba un resultado positivo.
| Método | RT-PCR | Resultados totais | ||
| Casete de proba rápida do antíxeno SARS-CoV-2 | Resultados | Positivo | Negativo | |
| Positivo | 38 | 3 | 41 | |
| Negativo | 2 | 360 | 362 | |
| Resultados totais | 40 | 363 | 403 | |
Sensibilidade relativa: 95,0 % (IC do 95 %*: 83,1 %-99,4 %)
Especificidade relativa: 99,2 % (IC do 95 %*: 97,6 %-99,8 %)
*Intervalos de confianza
Límite de detección
Cando o contido do virus é superior a 400 TCID50/ml, a taxa de detección positiva é superior ao 95 %. Cando o contido de virus é inferior a 200 TCID50/ml, a taxa de detección positiva é inferior ao 95%, polo que o límite mínimo de detección deste produto é de 400 TCID50/ml.
Precisión
Analizáronse tres lotes consecutivos de reactivos para comprobar a súa precisión. Utilizáronse diferentes lotes de reactivos para analizar a mesma mostra negativa 10 veces seguidas, e os resultados foron todos negativos. Utilizáronse diferentes lotes de reactivos para analizar a mesma mostra positiva 10 veces seguidas, e os resultados foron todos positivos.
Efecto GANCHO
Cando o contido de virus na mostra que se vai analizar alcanza 4,0 * 105TCID50/ml, o resultado da proba aínda non amosa o efecto GANCHO.
Reactividade cruzada
Avaliouse a reactividade cruzada do kit. Os resultados non mostraron reactividade cruzada coa seguinte mostra.
| Nome | Concentración |
| HCOV-HKU1 | 105TCID50/ml |
| Estafilococo áureo | 106TCID50/ml |
| Estreptococos do grupo A | 106TCID50/ml |
| Virus do sarampelo | 105TCID50/ml |
| Virus das parotidites | 105TCID50/ml |
| Adenovirus tipo 3 | 105TCID50/ml |
| pneumonía por micoplasmas | 106TCID50/ml |
| Virus da parainfluenza tipo 2 | 105TCID50/ml |
| Metapneumovirus humano | 105TCID50/ml |
| Coronavirus humano OC43 | 105TCID50/ml |
| Coronavirus humano 229E | 105TCID50/ml |
| Bordetella parapertusis | 106TCID50/ml |
| Gripe B Victoria STRAIN | 105TCID50/ml |
| Gripe B CEPA | 105TCID50/ml |
| Gripe A H1N1 de 2009 | 105TCID50/ml |
| Gripe A H3N2 | 105TCID50/ml |
| H7N9 | 105TCID50/ml |
| H5N1 | 105TCID50/ml |
| Virus de Epstein-Barr | 105TCID50/ml |
| Enterovirus CA16 | 105TCID50/ml |
| Rinovirus | 105TCID50/ml |
| Virus sincitial respiratorio | 105TCID50/ml |
| Streptococcus pneumoniae | 106TCID50/ml |
| Cándida albicans | 106TCID50/ml |
| Clamidia pneumoniae | 106TCID50/ml |
| Bordetella pertussis | 106TCID50/ml |
| Pneumocystis jiroveci | 106TCID50/ml |
| Mycobacterium tuberculosis | 106TCID50/ml |
| Legionella pneumophila | 106TCID50/ml |
Isubstancias interferentes
Os resultados da proba non se ven afectados pola substancia na seguinte concentración:
| Interferindo substancia | Conc. | Substancia interferente | Conc. |
| Sangue enteiro | 4% | Xel de benzoína composto | 1,5 mg/ml |
| Ibuprofeno | 1 mg/ml | Glicato de cromolina | 15% |
| tetraciclina | 3 µg/ml | cloranfenicol | 3 µg/ml |
| Mucina | 0,5% | Mupirocina | 10 mg/ml |
| Eritromicina | 3 µg/ml | Oseltamivir | 5 mg/ml |
| Tobramicina | 5% | Gotas nasais de clorhidrato de nafazolina | 15% |
| mentol | 15% | Spray de propionato de fluticasona | 15% |
| Afrin | 15% | Clorhidrato de desoxiepinefrina | 15% |
BIBLIOGRAFÍA
1. Weiss SR, Leibowitz JZ. Patoxénese do coronavirus. Adv Virus Res 2011;81:85-164
2. Cui J, Li F, Shi ZL. Orixe e evolución dos coronavirus patóxenos. Nat Rev Microbiol 2019;17:181-192.
3. Su S, Wong G, Shi W e outros. Epidemioloxía, recombinación xenética e patoxénese dos coronavirus. TrendsMicrobiol 2016;24:490-502.