SARS-CoV-2-Antigen-Schnelltestkassette
Kurze Beschreibung:
Die SARS-CoV-2-Antigen-Schnelltestkassette ist ein schneller chromatographischer Immunoassay zum qualitativen Nachweis des SARS-CoV-2-Antigens in menschlichen Oropharyngealabstrichen. Die Identifizierung basiert auf den monoklonalen Antikörpern, die spezifisch für das Nukleokapsid (N)-Protein von SARS-CoV-2 sind. Sie soll bei der schnellen Differentialdiagnose einer COVID-19-Infektion helfen.
VERWENDUNGSZWECK
DerSARS-CoV-2-Antigen-Schnelltestkassetteist ein schneller chromatographischer Immunoassay zum qualitativen Nachweis von SARS-CoV-2-Antigen in menschlichen Oropharyngealabstrichen. Die Identifizierung basiert auf den monoklonalen Antikörpern, die spezifisch für das Nukleokapsid (N)-Protein von SARS-CoV-2 sind. Er soll bei der schnellen Differentialdiagnose vonCOVID 19Infektion.
Paketspezifikationen
25 Tests/Packung, 50 Tests/Packung, 100 Tests/Packung
EINFÜHRUNG
Die neuartigen Coronaviren gehören zur Gattung β.COVID 19ist eine akute Infektionskrankheit der Atemwege. Menschen sind grundsätzlich anfällig. Derzeit sind mit dem neuartigen Coronavirus infizierte Patienten die Hauptinfektionsquelle; auch asymptomatische Infizierte können eine Infektionsquelle darstellen. Nach aktuellen epidemiologischen Untersuchungen beträgt die Inkubationszeit 1 bis 14 Tage, meist 3 bis 7 Tage. Zu den Hauptsymptomen gehören Fieber, Müdigkeit und trockener Husten. Verstopfte Nase, Schnupfen, Halsschmerzen, Myalgie und Durchfall treten in einigen Fällen auf.
REAGENZIEN
Die Testkassette enthält Anti-SARS-CoV-2-Nukleokapsidproteinpartikel und auf der Membran beschichtetes Anti-SARS-CoV-2-Nukleokapsidprotein.
VORSICHTSMASSNAHMEN
Bitte lesen Sie alle Informationen in dieser Packungsbeilage, bevor Sie den Test durchführen.
1. Nur für die professionelle In-vitro-Diagnostik. Nach Ablauf des Verfallsdatums nicht mehr verwenden.
2. Der Test sollte bis zur Verwendung im versiegelten Beutel bleiben.
3. Alle Proben sollten als potenziell gefährlich betrachtet und auf die gleiche Weise wie ein Infektionserreger behandelt werden.
4. Der verwendete Test sollte gemäß den örtlichen Vorschriften entsorgt werden.
5. Vermeiden Sie die Verwendung blutiger Proben.
6. Tragen Sie beim Umgang mit den Proben Handschuhe und vermeiden Sie es, die Reagenzmembran und die Probenvertiefung zu berühren.
LAGERUNG UND STABILITÄT
Die Gültigkeitsdauer beträgt 18 Monate, wenn dieses Produkt in einer Umgebung von
2–30 °C. Der Test ist bis zum auf dem versiegelten Beutel aufgedruckten Verfallsdatum stabil. Der Test muss bis zur Verwendung im versiegelten Beutel verbleiben..NICHT EINFRIEREN.Nach Ablauf des Verfallsdatums nicht mehr verwenden.
Probenentnahme und -aufbereitung
1. Entnahme von Rachensekret: Führen Sie einen sterilen Tupfer vom Mund aus vollständig in den Rachen ein, zentrieren Sie ihn auf der Rachenwand und dem geröteten Bereich der Gaumenmandeln, wischen Sie die beidseitigen Rachenmandeln und die hintere Rachenwand mit mäßiger
Kraft, vermeiden Sie es, die Zunge zu berühren, und nehmen Sie den Tupfer heraus.
2. Verarbeiten Sie die Probe sofort nach der Probenentnahme mit der im Kit enthaltenen Probenextraktionslösung. Wenn dies nicht sofort möglich ist, sollte die Probe in einem trockenen, sterilisierten und streng verschlossenen Plastikröhrchen aufbewahrt werden. Sie kann 8 Stunden lang bei 2–8 °C und über längere Zeit bei -70 °C gelagert werden.
3. Proben, die stark mit oralen Speiseresten verunreinigt sind, können nicht für den Test dieses Produkts verwendet werden. Proben, die mit zu viskosen oder verklumpten Tupfern entnommen wurden, werden für den Test dieses Produkts nicht empfohlen. Wenn die Tupfer mit einer großen Menge Blut verunreinigt sind, werden sie für den Test dieses Produkts nicht empfohlen. Es wird nicht empfohlen, Proben, die mit einer nicht im Kit enthaltenen Probenextraktionslösung verarbeitet wurden, für den Test dieses Produkts zu verwenden.
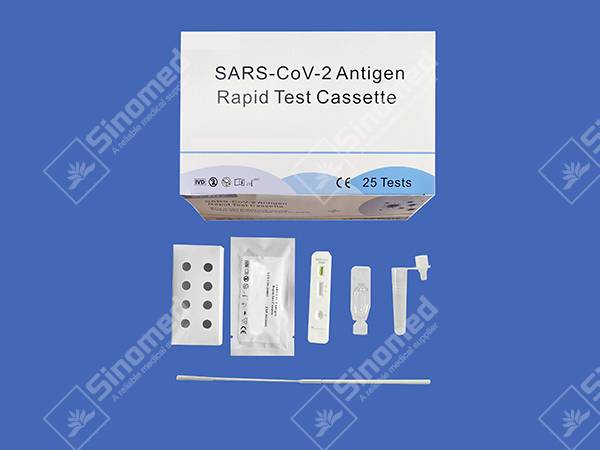
KIT-KOMPONENTEN
Materialien bieten
| Testkassetten | Extraktionsreagenz | Extraktionsröhrchen | |
| Sterile Tupfer | Packungsbeilage | Arbeitsplatz |
Benötigte, aber nicht bereitgestellte Materialien
| Timer | Zur Zeitmessung. |
| Paket |
Spezifikationen25
Tests/Packung 50
Tests/Packung 100
Tests/PackungProbenextraktionsreagenz25 Tests/Packung50 Tests/Packung100 Tests/PackungProbenextraktion
Röhrchen≥25 Tests/Packung≥50 Tests/Packung≥100 Tests/PackungAnweisungSiehe die
PaketSiehe die
PaketSiehe die
Paket
GEBRAUCHSANWEISUNG
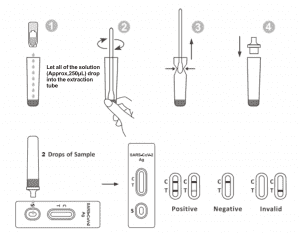
Lassen Sie den Test, die Probe und den Extraktionspuffer vor dem Test auf Raumtemperatur (15–30 °C) abkühlen.
1. Nehmen Sie die Testkassette aus dem versiegelten Folienbeutel und verwenden Sie sie innerhalb von 15 Minuten. Die besten Ergebnisse werden erzielt, wenn der Test unmittelbar nach dem Öffnen des Folienbeutels durchgeführt wird.
2. Legen Sie das Extraktionsröhrchen in die Arbeitsstation. Halten Sie die Flasche mit dem Extraktionsreagenz vertikal kopfüber. Drücken Sie die Flasche zusammen und lassen Sie die gesamte Lösung (ca. 250 μl) ungehindert in das Extraktionsröhrchen tropfen, ohne dass der Rand des Röhrchens das Extraktionsröhrchen berührt.
3. Legen Sie die Tupferprobe in das Extraktionsröhrchen. Drehen Sie den Tupfer etwa 10 Sekunden lang, während Sie den Kopf gegen die Innenseite des Röhrchens drücken, um das Antigen im Tupfer freizusetzen.
4. Entfernen Sie den Tupfer, während Sie den Tupferkopf beim Entfernen gegen die Innenseite des Extraktionsröhrchens drücken, um so viel Flüssigkeit wie möglich aus dem Tupfer zu entfernen. Entsorgen Sie den Tupfer gemäß Ihrem Entsorgungsprotokoll für biologische Gefahrenstoffe.
5. Setzen Sie die Tropferspitze auf das Extraktionsröhrchen. Legen Sie die Testkassette auf eine saubere und ebene Oberfläche.
6. Geben Sie 2 Tropfen der Lösung (ca. 65 μl) in die Probenvertiefung und starten Sie dann den Timer. Lesen Sie das angezeigte Ergebnis innerhalb von 20–30 Minuten ab. Die nach 30 Minuten abgelesenen Ergebnisse sind ungültig.
INTERPRETATION DER ERGEBNISSE
| NEGATIV ERGEBNIS: |
Im Kontrolllinienbereich (C) erscheint eine farbige Linie. Im Testbereich (T) erscheint keine Linie. Ein negatives Ergebnis zeigt an, dass das SARS-CoV-2-Antigen in der Probe nicht vorhanden ist oder unterhalb der Nachweisgrenze des Tests liegt.
POSITIVERGEBNIS:
Es erscheinen zwei Linien. Eine farbige Linie sollte sich im Kontrollbereich (C) und eine andere sichtbare farbige Linie im Testbereich (T) befinden. Ein positives Ergebnis zeigt an, dass SARS-CoV-2 in der Probe nachgewiesen wurde.
UNGÜLTIGES ERGEBNIS:
Die Kontrolllinie wird nicht angezeigt. Unzureichendes Probenvolumen oder falsche Verfahrenstechniken sind die häufigsten Gründe für das Versagen der Kontrolllinie. Überprüfen Sie den Vorgang und wiederholen Sie den Test mit einem neuen Test. Sollte das Problem weiterhin bestehen, stellen Sie die Verwendung des Testkits sofort ein und wenden Sie sich an Ihren lokalen Händler.
NOTIZ:
Die Farbintensität im Testlinienbereich (T) variiert je nach Konzentration des in der Probe vorhandenen SARS-CoV-2-Antigens. Daher sollte jeder Farbton im Testlinienbereich (T) als positiv gewertet werden.
QUALITÄTSKONTROLLE
- Der Test beinhaltet eine Verfahrenskontrolle. Eine farbige Linie im Kontrollbereich (C) gilt als interne Verfahrenskontrolle. Sie bestätigt eine ausreichende Membrandurchfeuchtung.
- Kontrollstandards werden nicht mit diesem Kit mitgeliefert. Es wird jedoch empfohlen, im Rahmen guter Laborpraxis positive und negative Kontrollen zu testen, um das Testverfahren zu bestätigen und die ordnungsgemäße Testleistung zu überprüfen.
EINSCHRÄNKUNGENDES TESTS
- Die SARS-CoV-2-Antigen-Schnelltestkassette ist nur für die professionelle In-vitro-Diagnostik bestimmt. Der Test sollte zum Nachweis von SARS-CoV-2-Antigen in Oropharyngealabstrichen verwendet werden. Mit diesem qualitativen Test können weder der quantitative Wert noch die Anstiegsrate der SARS-CoV-2-Konzentration bestimmt werden.
- Die Genauigkeit des Tests hängt von der Qualität der Abstrichprobe ab. Falsch-negative Ergebnisse können durch unsachgemäße Lagerung der Probenentnahme entstehen.
- Die SARS-CoV-2-Antigen-Schnelltestkassette zeigt das Vorhandensein von SARS-CoV-2 in der Probe nur bei lebensfähigen und nicht lebensfähigen SARS-CoV-2-Coronavirus-Stämmen an.
- Wie bei allen diagnostischen Tests müssen alle Ergebnisse zusammen mit anderen dem Arzt zur Verfügung stehenden klinischen Informationen interpretiert werden.
- Ein mit diesem Kit erhaltenes negatives Ergebnis muss durch PCR bestätigt werden. Ein negatives Ergebnis kann erzielt werden, wenn die Konzentration des im Abstrich vorhandenen SARS-CoV-2 nicht ausreichend ist oder unter der Nachweisgrenze des Tests liegt.
- Überschüssiges Blut oder Schleim auf der Abstrichprobe kann die Leistung beeinträchtigen und zu einem falsch positiven Ergebnis führen.
- Ein positives Ergebnis für SARS-CoV-2 schließt eine zugrunde liegende Koinfektion mit einem anderen Erreger nicht aus. Daher sollte die Möglichkeit einer zugrunde liegenden bakteriellen Infektion in Betracht gezogen werden.
- Negative Ergebnisse schließen eine SARS-CoV-2-Infektion nicht aus, insbesondere bei Personen, die Kontakt mit dem Virus hatten. Um eine Infektion bei diesen Personen auszuschließen, sollten Folgetests mit einem molekulardiagnostischen Verfahren in Betracht gezogen werden.
- Positive Ergebnisse können auf eine bestehende Infektion mit Nicht-SARS-CoV-2-Coronavirus-Stämmen wie den Coronaviren HKU1, NL63, OC43 oder 229E zurückzuführen sein.
- Die Ergebnisse von Antigentests sollten nicht als alleinige Grundlage für die Diagnose oder den Ausschluss einer SARS-CoV-2-Infektion oder zur Feststellung des Infektionsstatus verwendet werden.
- Das Extraktionsreagenz kann das Virus abtöten, es kann es jedoch nicht zu 100 % inaktivieren. Zur Inaktivierung des Virus kann auf die von der WHO/CDC empfohlene Methode verwiesen werden, oder es kann gemäß den örtlichen Vorschriften vorgegangen werden.
LEISTUNGSMERKMALE
EmpfindlichkeitUndSpezifität
Die SARS-CoV-2-Antigen-Schnelltestkassette wurde mit von Patienten gewonnenen Proben ausgewertet. Als Referenzmethode für die SARS-CoV-2-Antigen-Schnelltestkassette wird die PCR verwendet. Proben wurden als positiv betrachtet, wenn die PCR ein positives Ergebnis anzeigte.
| Verfahren | RT-PCR | Gesamtergebnisse | ||
| SARS-CoV-2-Antigen-Schnelltestkassette | Ergebnisse | Positiv | Negativ | |
| Positiv | 38 | 3 | 41 | |
| Negativ | 2 | 360 | 362 | |
| Gesamtergebnisse | 40 | 363 | 403 | |
Relative Sensitivität: 95,0 % (95 % KI*: 83,1 % – 99,4 %)
Relative Spezifität: 99,2 % (95 % KI*: 97,6 % – 99,8 %)
*Konfidenzintervalle
Nachweisgrenze
Wenn der Virengehalt größer als 400TCID ist50/ml, die positive Nachweisrate liegt über 95%. Wenn der Virusgehalt weniger als 200TCID beträgt50/ml, die positive Nachweisrate liegt unter 95 %, daher beträgt die Mindestnachweisgrenze dieses Produkts 400 TCID50/ml.
Präzision
Drei aufeinanderfolgende Chargen von Reagenzien wurden auf Präzision getestet. Verschiedene Chargen von Reagenzien wurden verwendet, um dieselbe negative Probe zehnmal hintereinander zu testen, und die Ergebnisse waren alle negativ. Verschiedene Chargen von Reagenzien wurden verwendet, um dieselbe positive Probe zehnmal hintereinander zu testen, und die Ergebnisse waren alle positiv.
HOOK-Effekt
Wenn der Virusgehalt in der zu testenden Probe 4,0*10 erreicht5TCID50/ml zeigt das Testergebnis immer noch nicht den HOOK-Effekt.
Kreuzreaktivität
Die Kreuzreaktivität des Kits wurde bewertet. Die Ergebnisse zeigten keine Kreuzreaktivität mit der folgenden Probe.
| Name | Konzentration |
| HCOV-HKU1 | 105TCID50/ml |
| Staphylococcus aureus | 106TCID50/ml |
| Streptokokken der Gruppe A | 106TCID50/ml |
| Masern Virus | 105TCID50/ml |
| Mumps Virus | 105TCID50/ml |
| Adenovirus Typ 3 | 105TCID50/ml |
| Mykoplasmenpneumonie | 106TCID50/ml |
| Paraimfluenzavirus Typ 2 | 105TCID50/ml |
| Humanes Metapneumovirus | 105TCID50/ml |
| Humanes Coronavirus OC43 | 105TCID50/ml |
| Humanes Coronavirus 229E | 105TCID50/ml |
| Bordetella parapertusis | 106TCID50/ml |
| Influenza B Victoria STAMM | 105TCID50/ml |
| Influenza B YSTAMM | 105TCID50/ml |
| Influenza A H1N1 2009 | 105TCID50/ml |
| Influenza A H3N2 | 105TCID50/ml |
| H7N9 | 105TCID50/ml |
| H5N1 | 105TCID50/ml |
| Epstein-Barr-Virus | 105TCID50/ml |
| Enterovirus CA16 | 105TCID50/ml |
| Rhinovirus | 105TCID50/ml |
| Respiratorisches Synzytial-Virus | 105TCID50/ml |
| Streptococcus pneumoni-ae | 106TCID50/ml |
| Candida albicans | 106TCID50/ml |
| Chlamydia pneumoniae | 106TCID50/ml |
| Bordetella pertussis | 106TCID50/ml |
| Pneumocystis jiroveci | 106TCID50/ml |
| Mycobacterium tuberculosis | 106TCID50/ml |
| Legionella pneumophila | 106TCID50/ml |
IStörende Substanzen
Die Testergebnisse werden durch die Substanz in folgender Konzentration nicht beeinflusst:
| Einmischen Substanz | Konz. | Störsubstanz | Konz. |
| Vollblut | 4% | Zusammengesetztes Benzoin-Gel | 1,5 mg/ml |
| Ibuprofen | 1 mg/ml | Cromoglykat | 15 % |
| Tetracyclin | 3 µg/ml | Chloramphenicol | 3 µg/ml |
| Mucin | 0,5 % | Mupirocin | 10 mg/ml |
| Erythromycin | 3 µg/ml | Oseltamivir | 5 mg/ml |
| Tobramycin | 5% | Naphazolinhydrochlorid-Nasentropfen | 15 % |
| Menthol | 15 % | Fluticasonpropionat-Spray | 15 % |
| Afrin | 15 % | Desoxyepinephrinhydrochlorid | 15 % |
BIBLIOGRAFIE
1.Weiss SR,Leibowitz JZ.Coronavirus pathogenesis. Adv Virus Res 2011;81:85-164
2.Cui J,Li F,Shi ZL.Ursprung und Evolution pathogener Coronaviren.Nat Rev Microbiol 2019;17:181-192.
3.Su S,Wong G,Shi W,et al.Epidemiologie, genetische Rekombination und Pathogenese von Coronaviren. TrendsMicrobiol 2016;24:490-502.